LOS LÍQUIDOS
LOS LÍQUIDOS
INTRODUCCIÓN
A continuación hablaremos sobre la información correspondiente a los líquidos, tenemos que tener en cuenta que los líquidos son componentes principales de muchos objetos existentes en el planeta tierra además de tener un alto grado de importancia en la vida cotidiana de todos los seres humanos.
Nos enfocaremos en propiedades físicas, químicas y sus estados naturales para así de esta manera tener claro todas las características que rodean a este elemento
OBJETIVOS GENERALES
- Informar sobre los líquidos
- Caracterizar los líquidos en cada tema
- Demostrar el uso de los líquidos en la vida cotidiana para la aplicación de manera correcta
OBJETIVOS ESPECÍFICOS
- Analizar los diferentes procesos por los que se someten los líquidos
- Conceptuar los procesos físicos y químicos de los líquidos
- Distinguir las transformaciones de los líquidos
MARCO TEÓRICO
EVAPORACIÓN: la
evaporación es un proceso físico que consiste en el paso lento y gradual de un
estado líquido hacia un estado gaseoso. Se puede producir a cualquier
temperatura, siendo más rápido cuanto más elevada sea ésta.
La
evaporación de agua es importante e indispensable en la vida, ya que el vapor
de agua, al condensarse se transforma en nubes y vuelve en forma de lluvia,
nieve, niebla o rocío.
En un
líquido, las moléculas se mueven constantemente y a la vez están unidas entre sí
por fuerzas de atracción. Las moléculas chocan unas contra otras como las bolas
en una mesa de billar. El calentamiento aumenta la agitación de las moléculas.
Cada vez se agitan más y algunas escapan fuera del líquido y terminan en la
atmósfera. Algunos líquidos se evaporan más rápido que los demás a la misma
temperatura. Esto se debe a que las fuerzas que mantienen unidas las moléculas
en el líquido son menores.

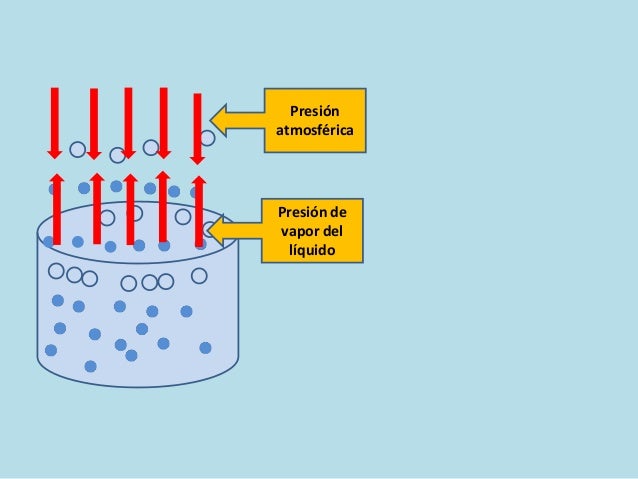
PRESIÓN DE VAPOR: la presión
de vapor o más comúnmente presión de saturación es la presión a la que a cada
temperatura las fases líquida y vapor se encuentran en equilibrio; su valor es
independiente de las cantidades de líquido y vapor presentes mientras existan
ambas. En la situación de equilibrio, las fases reciben la denominación de
líquido saturado y vapor saturado.
Imaginemos
una ampolla de cristal en la que se ha realizado el vacío y que se mantiene a
una temperatura constante. Si introducimos una cierta cantidad de líquido en su
interior éste se evapora rápidamente al principio hasta que se alcance el
equilibrio entre ambas fases.
Las
moléculas de la superficie del líquido que tengan una mayor energía escaparan
de la superficie y pasarán a la fase vapor (evaporación) mientras que las
moléculas del vapor chocarán con las paredes de la ampolla y entre sí, perderán
energía y caerán al líquido (condensación).
Inicialmente
sólo se produce la evaporación, ya que no hay vapor; sin embargo, a medida que
la cantidad de vapor aumenta y por tanto la presión, en el interior de la
ampolla se va incrementando también la velocidad de condensación, hasta que,
transcurrido un cierto tiempo, ambas velocidades se igualan. Llegado este
punto, se habrá alcanzado la presión máxima posible en la ampolla (presión de
vapor o de saturación), que no podrá superarse salvo que se incremente la
temperatura.
El
equilibrio se alcanzará más rápidamente cuanta mayor sea la superficie de
contacto entre el líquido y el vapor, pues así se favorece la evaporación del
líquido, del mismo modo que un charco de agua extenso, pero de poca
profundidad, se seca más rápido que uno más pequeño, pero de mayor profundidad,
que contenga igual cantidad de agua. Sin embargo, el equilibrio se alcanza en
ambos casos para igual presión.
El factor
más importante que determina el valor de la presión de saturación es la propia
naturaleza del líquido, de modo que, en general, entre líquidos de naturaleza
similar, la presión de vapor a una temperatura dada es tanto menor cuanto mayor
es el peso molecular del líquido.
EBULLICIÓN: la
ebullición es el proceso físico en el que un líquido pasa a estado gaseoso a
alta temperatura (el agua a 100 °C).
Ocurre
cuando la temperatura de la totalidad del líquido iguala al punto de ebullición
del líquido a esa presión. Si se continúa calentando el líquido, éste absorbe
el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión
del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de
la masa pasa al estado gaseoso. En ese momento es posible aumentar la
temperatura del líquido.
Punto de ebullición: la
ebullición comienza cuando al calentar un líquido aparecen burbujas de gas en
toda su masa. Esto ocurre a una temperatura fija para cada sustancia.
Se llama
punto de ebullición de una sustancia a la temperatura a que se produce la
ebullición de dicha sustancia.
A nivel
microscópico ocurre que casi todas las partículas tienen energía suficiente
para escapar del líquido y liberarse en forma de gas.
Ebullición del agua: este
proceso es muy distinto a la evaporación, que es paulatino y para el que, en
altitudes superiores, la presión atmosférica media disminuye, por lo que el
agua necesita temperaturas menores para entrar en ebullición.
En una olla
a presión, el agua llega a una temperatura de 120 o 130 °C antes de hervir,
debido a la mayor presión alcanzada por los gases en su interior. Gracias a
esta mayor temperatura del agua en el interior de la olla, la cocción de la
comida es más rápida. La adición de aditivos al agua puede hacer aumentar su
punto de ebullición. Y algunos microorganismos también mueren a esta
temperatura.
VISCOSIDAD: es lo opuesto de fluidez; puede definirse de modo simplificado, como la mayor o
menor resistencia que ofrece un líquido para fluir libremente. Todos los
líquidos poseen algo de viscosidad.
En términos
generales la viscosidad de un líquido es independiente de su densidad o
gravedad específica, pero sí depende de la temperatura a que se encuentre,
siendo inversamente proporcional a esta.
La fuerza
con la que una capa de fluido en movimiento arrastra consigo a las capas
adyacentes de fluido determina su viscosidad. De ahí que los fluidos de alta
viscosidad presentan resistencia al fluir, mientras que los de baja viscosidad
fluyen con más facilidad.

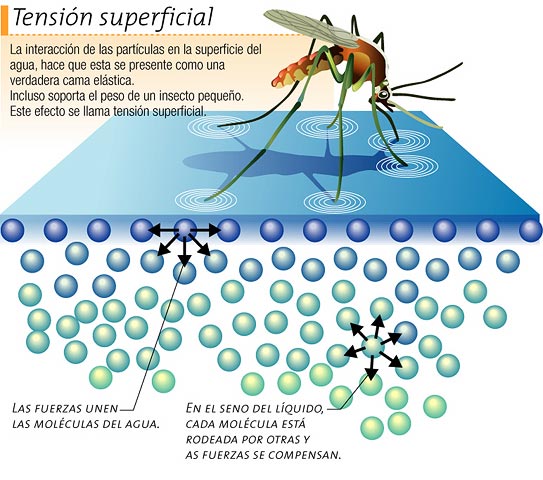
TENSIÓN SUPERFICIAL: la tensión
superficial es un término que suele aplicarse a los líquidos porque es una
forma de medir la cohesión que existe entre las moléculas de ese líquido. Todas
las moléculas que componen una sustancia líquida interaccionan de alguna forma
entre ellas y se atraen, se dice que un líquido tiene más o menos cohesión
según si sus moléculas se atraen más o menos entre ellas, respectivamente.
Pero la
tensión superficial se aplica sólo sobre las superficies de un líquido. Cuando
nos encontramos sobre la superficie del líquido las moléculas que están justo
debajo de la superficie sienten esa atracción sólo por las moléculas que tienen
a los lados y hacia abajo, pero en la parte superior no tienen más moléculas,
sólo la superficie. Como resultado, estas moléculas sienten una fuerza que las
estira hacia abajo, hacia el interior del líquido.
EL AGUA
INTRODUCCIÓN
En este informe hablaremos de el agua y todas sus características y especificaciones cómo sus propiedades físicas y químicas.
Este elemento es el más importante para la vida humana y compone más del 70 por ciento de el territorio del planeta tierra y también compone más del 70 por ciento del cuerpo humano, este elemento es necesario para la hidratación de las especies existentes en el mundo y también es utilizada en la industria para la creación de otros productos necesarios para la vida cotidiana del ser humano.
OBJETIVOS GENERALES
- Categorizar las aguas
- Explicar propiedades Y procesos del H2O
OBJETIVOS ESPECÍFICOS
- Definir la estructura molecular del agua
- Mencionar las propiedades del agua tanto químicas como biológicas
- Mencionar los distintos tipos de aguas
- Analizar la contaminación del agua
MARCO TEÓRICO
ESTRUCTURA MOLECULAR: el agua tiene una estructura molecular simple. Está compuesta por un átomo de oxígeno y dos de hidrógeno. Cada átomo de hidrógeno se encuentra unido covalentemente al oxígeno por medio de un par de electrones de enlace. El oxígeno tiene además dos pares de electrones no enlazantes. De esta manera existen cuatro pares de electrones rodeando al átomo de oxígeno: dos pares formando parte de los enlaces covalentes con los átomos de hidrógeno y dos pares no compartidos en el lado opuesto. El oxígeno es un átomo electronegativo o "amante" de los electrones, a diferencia del hidrógeno.
PROPIEDADES QUÍMICAS:
- Reacciona con los óxidos ácidos
- Reacciona con los óxidos básicos
- Reacciona con los metales
- Reacciona con los no metales
- Se une en las sales formando hidratos
- Los anhídridos u óxidos ácidos reaccionan con el agua y forman ácidos oxácidos.
- Los óxidos de los metales u óxidos básicos reaccionan con el agua para formar hidróxidos. Muchos óxidos no se disuelven en el agua, pero los óxidos de los metales activos se combinan con gran facilidad.
- Algunos metales descomponen el agua en frío y otros lo hacían a temperatura elevada.
- El agua reacciona con los no metales, sobre todo con los halógenos, por ej: Haciendo pasar carbón al rojo sobre el agua se descompone y se forma una mezcla de monóxido de carbono e hidrógeno (gas de agua).
- El agua forma combinaciones complejas con algunas sales, denominándose hidratos. En algunos casos los hidratos pierden agua de cristalización cambiando de aspecto, y se dice que son eflorescentes, como le sucede al sulfato cúprico, que cuando está hidratado es de color azul, pero por pérdida de agua se transforma en sulfato cúprico anhidro de color blanco.
PROPIEDADES BIOLÓGICAS: cada
molécula de agua puede potencialmente formar 4 puentes de hidrógeno con otras
tantas moléculas de agua dando lugar a una estructura tetraédrica reticular
relativamente ordenada, responsable de sus peculiares propiedades
físico-químicas.
El agua es
el principal disolvente biológica, permite el transporte en el interior de los
seres vivos y su intercambio con el medio externo, facilitando el aporte de sustancias
nutritivas y la eliminación de productos de desecho. Además, constituye el medio
en el que se realizan la mayoría de las reacciones bioquímicas. El agua, un
compuesto extraordinariamente simple, es sin embargo una
sustancia de características tan excepcionales y únicas
que sin ella sería imposible la vida. Cabe preguntarse qué es lo que hace de
ella una sustancia tan especial y tan diferente de otras.
El
"secreto" de sus excepcionales características está precisamente en
su composición y estructura, que le confieren el mayor número de
propiedades físicas y químicas "anómalas" entre las sustancias
comunes, y esta "personalidad" es la responsable de su
esencialidad en la homeostasis, estructura y función de las células y
tejidos del organismo.
ELECTROLISIS DE AGUA: la
electrólisis es un proceso electroquímico de oxidación-reducción que ocurre al
pasar la energía eléctrica a través de un electrólito fundido o disolución
acuosa.
En el caso
del agua para que este proceso ocurra se deben cumplir las siguientes
condiciones:
- El agua no puede estar en estado puro, o sea debe tener pequeñas concentraciones de sales u otros minerales.
- Se debe usar corriente directa en este proceso.
En este
proceso se le llama cátodo al electrodo que aporta la carga negativa a la
disolución acuosa o electrólito fundido, mientras al otro electrodo que es el
responsable de la carga negativa se le llama ánodo.
La
electrólisis del agua permite que se obtenga los elementos químicos que la
componen de forma pura o sea el hidrógeno(H) a través del cátodo y el
oxígeno(O) a través del ánodo, ambos en estado gaseoso. Este proceso se le
puede aplicar al agua dulce y a la salada obteniéndose resultados diferentes
teniendo en cuenta las sustancias producto. En el caso del agua salada las
sustancias que se obtienen a través del ánodo y el cátodo son el cloro (Cl) y
el hidrógeno (H) respectivamente ambos en estado gaseoso, quedando al final del
proceso una disolución de hidróxido de sodio (NaOH).

AGUAS DURAS: el agua
dura es un agua que no produce espuma con el jabón. El agua dura forma un
residuo grisáceo con el jabón, que a veces altera el color de la ropa sin poder
lavarla correctamente, forma una dura costra en las ollas y en los grifos y,
algunas veces, tienen un sabor desagradable.
El agua dura contiene iones que
forman precipitados con el jabón o por ebullición.
Las
características del agua dura se deben a la presencia de sales de magnesio y
calcio
El agua
dura puede volver a ser blanda, con el agregado de carbonato de sodio o
potasio, para precipitarlo como sales de carbonatos.
AGUAS PESADAS: agua
formada con átomos de hidrógeno pesado, es decir, con los isótopos deuterio (lo
más común dada su abundancia relativa) o tritio.
Se emplea,
entre otras cosas, en procesos de separación de uranio fisionable.
PERÓXIDO DE HIDRÓGENO: el peróxido
de hidrógeno, también conocido como agua oxigenada, es un producto químico muy
reactivo compuesto por hidrógeno y oxígeno. Su fórmula estructural es:
HO → OH
El peróxido
de hidrógeno puro es un líquido incoloro, pero el compuesto se comercializa
como solución acuosa, con un contenido de hasta el 33 / 37% de peróxido de
hidrógeno puro y otros aditivos que impiden la descomposición del producto.
El peróxido
de hidrógeno se utiliza como decolorante o desinfectante en productos de
consumo como tintes decolorantes para el pelo, productos para la permanente,
alisadores de pelo, gotas para los oídos, en colutorios antisépticos, productos
para tratar las llagas bucales, pastas de dientes y blanqueamiento dental.
También se utiliza en soluciones para la desinfección de lentes de contacto y
heridas.
CONTAMINACIÓN DEL AGUA: la
contaminación hídrica o la contaminación del agua es una modificación de esta,
generalmente provocada por el ser humano, que la vuelve impropia o peligrosa
para el consumo, la industria, la agricultura, la pesca y las actividades, así
como para los animales.
Aunque la
contaminación de las aguas puede provenir de fuentes naturales, como la ceniza
de un volcán, la mayor parte de la contaminación actual proviene de actividades
humanas.
El
desarrollo y la industrialización suponen un mayor uso de agua, una gran
generación de residuos, muchos de los cuales van a parar al agua y el uso de
medios de transporte fluvial y marítimo que, en muchas ocasiones, son causa de
contaminación de las aguas por su petróleo o combustible. Las aguas
superficiales son en general más vulnerables a la contaminación de origen
antrópico que las aguas subterráneas, por su exposición directa a la actividad
humana. Por otra parte, una fuente superficial puede restaurarse más
rápidamente que una fuente subterránea a través de ciclos de escorrentía
estacionales. Los efectos sobre la calidad serán distintos para lagos y
embalses que, para ríos, y diferentes para acuíferos de roca o arena y grava de
arena.
La
presencia de contaminación genera lo que se denominan “ecosistemas forzados”,
es decir ecosistemas alterados por agentes externos, desviados de la situación
de equilibrio previa obligados a modificar su funcionamiento para minimizar la
tensión a la que se ven sometidos.

CONCLUSIONES
Podemos concluir que los líquidos son sometidos a diferentes procesos como la evaporación y la ebullición, que una de sus características físicas puede ser la viscosidad. Por otro lado el agua es una de las sustancias más importantes para el planeta y puede ser dura o pesada. su estructura molecular consta de dos moleculas de Hidrogeno y una de Oxígeno, consta de propiedades químicas y biológicas muy importantes y por último sobre la contaminacion hídrica, podemos decir que si no se cuida el agua podríamos morir
WEBGRAFÍA
- https://es.vikidia.org/wiki/Evaporaci%C3%B3n
- https://www.ecured.cu/Presi%C3%B3n_de_vapor
- https://iquimicas.com/que-es-la-ebullicion/
- https://www.ecured.cu/Ebullici%C3%B3n
- https://www.ecured.cu/Viscosidad
- http://www.sc.ehu.es/sbweb/fisica/fluidos/tension/introduccion/introduccion.htm
- https://cienciatoday.com/que-es-la-tension-superficial/
- https://es.slideshare.net/alycyalopez/estructura-molecular-del-agua-alr
- https://www.monografias.com/trabajos14/propiedades-agua/propiedades-agua.shtml#pr
- https://www.biologuias.com/base-molecular/agua/
- https://www.ecured.cu/Electr%C3%B3lisis_del_agua
- http://enciclopedia.us.es/index.php/Agua_pesada
- https://es.wikipedia.org/wiki/Contaminaci%C3%B3n_h%C3%ADdrica
- https://prezi.com/ppbz4r_-gvng/propiedades-biologicas-del-agua/#targetText=Elevada%20cohesion%20molecular&targetText=El%20agua%20es%20un%20componente,siendo%20el%20disolvente%20general%20biol%C3%B3gico.&targetText=Incluso%20muchas%20mol%C3%A9culas%20org%C3%A1nicas%20no,coloidales%2C%20con%20importantes%20propiedades%20biol%C3%B3gicas.
Comentarios
Publicar un comentario