SEGUNDO PERIODO

INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN

ESTEQUIOMETRÍA
DOCENTE: DIANA FERNANDA JARAMILLO
ALUMNA: JENNIFER JULIANA GIRALDO
GRADO: 10-1
FECHA: 02/06/2019
IBAGUÉ-TOLIMA
INTRODUCCIÓN
Todos sabemos que la química inorgánica es la encargada de estudiar la composición y las propiedades de la materia, asimismo las transformaciones que esta experimenta sin que se alteren los elementos que la forman.
En otras palabras es la que estudia los cuerpos simples y los compuestos que no contienen carbono en sus moléculas.
Por ende, se hablará acerca de los temas abordados en el laboratorio virtual realizado en yenka donde utilizamos algunos temas de "ecuaciones y cantidades".
OBJETIVOS
- Identificar los temas de "ecuaciones y cantidades" que son: Reacciones en equilibrio, compuestos y reacciones químicas, fórmula empírica, equilibrio y temperatura y moles y masas.
- Comprender sus funciones y respuestas con distintos elementos
- Analizar los procesos que se evidenciaron en el transcurso del laboratorio
- Describir lo aprendido en distintas conclusiones
REACCIONES EN EQUILIBRIO
MARCO TEÓRICO
Se le llama equilibrio químico al estado de un sistema donde no se observan cambios en la concentración de reactivos o productos, al transcurrir el tiempo, éstas se mantienen constantes. Esto se da en reacciones reversibles, donde la velocidad de la reacción de reactivos a productos es la misma que de productos a reactivos.
aA+bB⇆cC+dD
Siendo A y B los reactivos, C y D los productos. Las letras minúsculas delante de cada uno son sus respectivos coeficientes estequiométricos, es decir, las moles.
La constante del equilibrio K, puede definirse como la relación entre el producto de las concentraciones de los productos (en el equilibrio) elevadas a sus correspondientes coeficientes estequiométricos, y el producto de las concentraciones de los reactivos (en el equilibrio) elevadas a su vez,en sus correspondientes coeficientes estequiométricos. Esta constante sufre variaciones con la temperatura.
k+ {C}c {D}d
K=______=_______________
{A}a {B}b
k-
Existen varios factores que pueden alterar el estado de equilibrio químico, los más importantes son la temperatura, la presión y la concentración de los reactivos o productos.
ACTIVIDAD INTERACTIVA
EQUILIBRIO (CLORURO DE AMONIO)
MARCO TEÓRICO
Al observar el cloruro de amonio en la barra de detalles , nos podemos dar cuenta que es una reacción tipo reversible.
Podemos representar la síntesis de amoníaco mediante la siguiente reacción reversible:
N2 (g) + 3H2 (g) * 2NH3 (g)
La reaccion es exotermica (libre de calor); entonces, la descomposición de amoniaco sera endotérmica (absorbe calor)
Es una sal formada de ácido que puede ayudar a corregir las situaciones en las cuales la sangre contiene muy poco cloruro o cuando es demasiado alcalina (básica). Puede obtenerse por diversos métodos, el primero es a través de la neutralización con HCl del residuo amoniacal formado en la destilacion del carbon: NH3 + HCl→NH4Cl.
ACTIVIDAD INTERACTIVA
MOLES Y MASAS
MARCO TEÓRICO
La masa molecular es la masa de una molécula de un compuesto. Se calcula sumando las masas atómicas relativas de todos los átomos que forman dicha molécula. Se mide en unidades de masa atómica, representadas como uma.
La masa molar coincide numéricamente con la masa molecular, pero son dos cosas distintas.
Mientras que la masa molecular es la masa de una molécula, la masa molar es la masa de un mol de compuesto, es decir, del número de Avogadro de moléculas. La masa molecular en uma coincide numéricamente con la masa molar en gramos.
La masa molar expresa la relación constante entre la masa y la cantidad de sustancia que caracteriza a toda muestra de sustancia, su símbolo es Mol o Moles.
ACTIVIDAD INTERACTIVA
REACCIÓN REVERSIBLE
MARCO TEÓRICO
Una reacción reversible es una reacción química en la que los reactivos forman productos que, a su vez, reaccionan juntos para devolver los reactivos. Las reacciones reversibles alcanzarán un punto de equilibrio en el que las concentraciones de los reactivos y productos ya no cambiarán.
Una reacción reversible se denota por una flecha doble que apunta en ambas direcciones en una ecuación química. Por ejemplo, una ecuación de dos reactivos y dos productos se escribiría de la siguiente manera
A + B ⇆ C + D
ACTIVIDAD INTERACTIVA
CALCULO DEL RENDIMIENTO
MARCO TEÓRICO
Dentro del ámbito de la química, el rendimiento teórico es la cantidad máxima de producto que puede crear una reacción química. En realidad, la mayoría de las reacciones no tiene una eficacia perfecta. Al realizar el experimento, obtendrás una cantidad menor, lo que se denomina rendimiento real.
Si quieres expresar la eficacia de una reacción, puedes calcular el rendimiento porcentual mediante la siguiente fórmula:
% de rendimiento= rendimiento real/rendimiento teórico x 100%
ACTIVIDAD INTERACTIVA
COMPUESTOS Y REACCIONES QUÍMICAS
MARCO TEÓRICO
Un compuesto químico es una sustancia formada por la unión de dos o más elementos de la tabla periódica, combinados en una proporción fija de sus masas. una característica esencial es que tiene una fórmula química precisa.
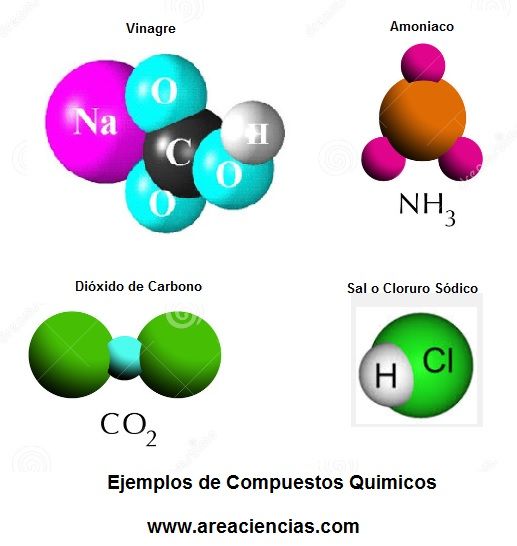
Una reacción química es un proceso en el que unas sustancias químicas llamadas reactivos se transforman en nuevas sustancias llamadas productos, con intercambio de energía.
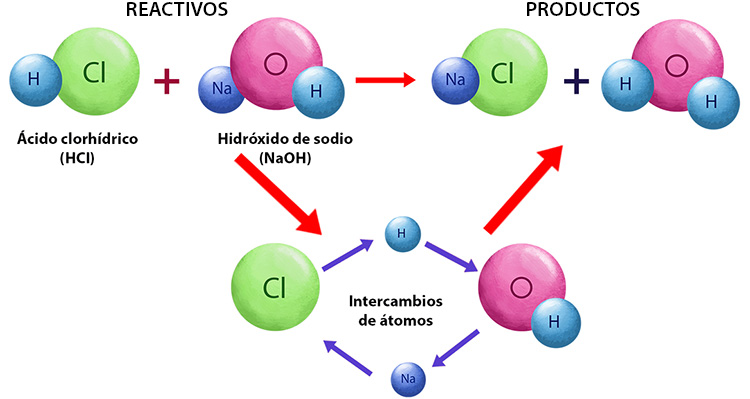
CONCLUSIONES
- El equilibrio de una reacción tiene que ver con los reactivos y productos
- El cloruro de amonio es una reacción exotérmica es decir libre de calor y su descomposición es endotérmica que significa absorbe el calor
- La masa molecular es la masa de una molécula y la masa molar es la masa de un mol de compuesto o del número de avogadro de moléculas
- La reacción reversible es cuando los reactivos forman productos y que estos reaccionan juntos para devolver los reactivos
- En él laboratorio virtual el cálculo del rendimiento se hago con 3 ácidos distintos
- Los Objetivos propuestos al comienzo, se lograron completamente
WEBGRAFÍA
- http://100cia.site/index.php/quimica/item/5258-que-es-una-reaccion-reversible-ejemplos
- https://www.ecured.cu/Masa_molar
- https://es.slideshare.net/elprofetito/xidos-bsicos-frmulas-nombres-ecuacin-qumica-y-balanceo-presentation
- https://www.academia.edu/6834771/FORMULA_EMPIRICA
- https://es.wikipedia.org/wiki/Compuesto_qu%C3%ADmico
- https://quimica.laguia2000.com/reacciones-quimicas/equilibrio-quimico
- Apuntes de mi cuaderno de química
EL INFORME DE CADA PRACTICA ERA APARTE 4,5
ResponderBorrar